蛋白質物性学研究所 / Institute for Protein Physics
トピックス
(T.1) 変性した蛋白質分子の可逆的会合状態(RO)
(T.2) 一本鎖核酸への低温ショック蛋白質(CSP)の結合機構
(T.3) 等温滴定熱量測定(ITC)によるATP加水分解酵素の活性・阻害の評価
(T.4) 蛋白質のDSC測定開始40周年
(T.5) 熱測定誌で「タンパク質分子の熱量測定」連載が始まりました
(T.6) Double Deconvolution (DDCL)法開発40周年
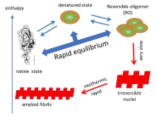 |
(T.1) 変性した蛋白質分子の可逆的会合状態(RO) | |
| 変性した蛋白質分子は一般に会合しやすく、不可逆的に大きな凝集体を形成して不溶化する場合が多い(「蛋白質」という名前は凝集体が溶液中で白く見えることから)と考えられています。ゆで卵が温度を下げても生卵に戻らない主な原因はこの凝集形成の不可逆性のためです。しかし、最近の研究で、変性した数分子の蛋白質分子が可逆的に会合して平衡論的に安定な一つの熱力学的状態を形成する例が、様々な蛋白質で報告されてきています。そして、この会合体が、不可逆的凝集体の一種であるアミロイドを形成するための核の前駆体になっている可能性を示す実験結果も報告されています。我々は、このような変性した蛋白質が形成する可逆的な会合体をRO(reversible oligomer)と呼んで研究を続けています。 【Reference】最新の原著論文、最新の解説 |
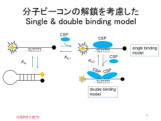 |
(T.2) 一本鎖核酸への低温ショック蛋白質(CSP)の結合機構 | |
| 低温ショック蛋白質(CSP)は、一本鎖核酸に強く結合し、細胞中での核酸の立体構造を制御する重要な機能を持つ。結合能の解析には、滴定熱量測定(ITC)等が使われるが、感度の問題から通常μM程度の濃度で行われる。これらのデータは単純な1対1モデル(single binding model)を用いて解析されているが、結合定数の温度依存性から求めたvan't HoffエンタルピーとITCで直接測定された熱測定エンタルピーと一致しないという問題があった。我々は、安定性を制御して設計した分子ビーコン(MB)を用いることで、蛍光測定により、nMレベルの高感度での結合性およびμMレベルの結合性の評価に成功した。その結果、特異的にCSPが結合する塩基配列に1分子が結合する場合の結合定数は、ITCで評価されていた値よりも1桁大きいこと、μMの濃度では、一本鎖核酸にCSP2分子が協同的に結合することで、結合定数が過小評価されていることが示唆された。 (第60回記念熱測定討論会、京都府立大、2024年9月)要旨 |
||
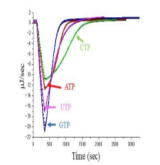 |
(T.3) 等温滴定熱量測定(ITC)によるATP加水分解酵素の活性・阻害の評価 | |
| 本研究では、トマトモザイクウイルス由来の安定ヘリカーゼドメインによるATP等の加水分解反応の全時間経過を、等温滴定熱量測定(ITC)によって観測した。ヘリカーゼはDNA等の核酸の形成する2重らせんをATPの加水分解のエネルギーを使って1本鎖にほどく機能を持つ酵素である。基質の初期濃度を変化させた全時間経過の解析は、見かけのミカエリス定数の初期基質濃度依存性を示し、生成物(ADPなど)による競合阻害が明確に示された。真のミカエリス定数と阻害定数を比較することで、酵素はATPに対してADPよりも17倍高い親和性を持つことがわかった。また、この方法を用いて、本酵素の阻害剤をスクリーニングした。(本研究の成果は、東洋大・加藤悦子教授を筆頭著者として、熱測定誌に受理されました。) 【論文】 |
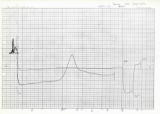 |
(T.4) 蛋白質のDSC測定開始40周年 | |
| 1985年1月24日、筑波の工業技術院繊維高分子材料研究所(現在の産総研)で最初のDSC測定を行ってからちょうど40年になります。測定をご指導いただいた繊維高分子材料研究所(当時)の上平初穂博士と当時の指導教員の和田昭允教授に改めて深く御礼申し上げます。なお、左図は、この時測定したチャートです。ブタ由来の酵素蛋白質pepsinogenのpH 8.3での熱転移を、1 K/minの昇温速度で、当時日本に1台しかなかったソ連(現在のロシア)製の高精度の断熱型示差走査熱量計DASM-1Mで測定しました。熱転移に伴う吸熱ピークの高温側に、幅広く裾を引いた吸熱ピークが観測されています。 【公表論文のFig.6参照】 |
 |
(T.5) 熱測定誌で「タンパク質分子の熱量測定」連載が始まりました | |
| 日本熱測定学会の学会誌「熱測定」で、2025年4月号から4回シリーズでチュートリアル「タンパク質分子の熱量測定」の連載を担当しています。記事の掲載が始まりました(別刷りのご請求はkidokoro@proteinphys.orgまでお知らせ下さい)。 第1回目の項目は、以下の通りで、タンパク質分子の熱量測定の特徴や測定原理や測定装置の共同利用について解説・紹介しています。 1. はじめに 2. 測定対象としてのタンパク質分子の特徴 3. タンパク質分子の熱量測定の原理 4. 等温滴定熱量測定(ITC) 5. 熱量測定装置の共同利用について 【第1回目の記事】 第2回目の項目は、以下の通りで、タンパク質分子の立体構造変化や安定性を中心に、多様な熱力学状態間の転移の測定法・解析法について述べています。 1.はじめに 2.タンパク質分子が示す多様な熱力学状態 3.立体構造転移の可逆過程での観測 4.不可逆な立体構造転移のDSC 【第2回目の記事】 第3回目は、タンパク質分子とリガンドとの結合についての熱量測定についてがテーマで下記の項目で執筆しました。特に、pHを一定に保つために共存させる緩衝剤からの熱の扱いや、最も単純な1対1モデルによる解析、複雑な系への適用などについて議論しています。 1. はじめに 2. タンパク質分子共通のリガンド「水素イオン」 3. 緩衝剤の水素イオンの解離エンタルピー 4. 酵素・阻害剤の結合評価 5. より複雑な系の結合評価 【第3回目の記事】 第4回(最終回)は、良く知られたMichaelis-Menten機構を元にして、タンパク質分子の触媒能評価における熱量測定の特長について下記項目で解説しています。 1. はじめに 2. 酵素反応の定常状態と Michaelis-Menten式 3. 酵素反応観測における熱量測定の特長 4. 酵素反応の時間経過測定 |
 |
|
(T.6) Double Deconvolution (DDCL)法開発40周年 |
| 1985年8月27日、Biopolymers誌に論文を投稿し、約1年後の1986年8月25日に受理され、1987年に掲載されました。この論文は、蛋白質やその他の物質の熱容量(DSCデータ)を解析するための統計力学的基礎を提示しました。また、当時主流だった二状態解析法(実験データから低温と高温の2つの状態の熱容量関数を推定)と同じ手順を用いて、状態数を仮定することなく、各状態のモル分率と、中間状態が存在する場合のエンタルピー関数を評価できることを示しています。本方法は、蛋白質濃度によって平衡が変化しない系を対象にしていますが、約1年後の第2報では、自己解離・会合過程を含む系に拡張できることを示しました。この40年間、様々な系に本方法は適用されてきましたが、更に広く使っていただけるよう、技術支援などをしてゆきたいと思います。 |