蛋白質物性学研究所 / Institute for Protein Physics
蛋白質物性学研究所 / Institute for Protein Physics
基盤的手法
(C.1)物理的摂動法
(C.2)Double Deconvolution (DDCL)法
(C.3)平衡論的・速度論的モデルを用いた解析法
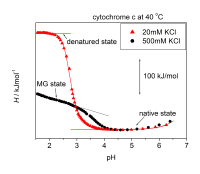
| (C.1) 物理的摂動法 |
|---|
|
|
| |
| (C.2) Double Deconvolution (DDCL)法 |
|---|
|
|
| |
| (C.3) 平衡論的・速度論的モデルを用いた解析法 |
|---|
|
|
| |