蛋白質物性学研究所 / Institute for Protein Physics
トピックス
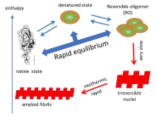
| (T.1)変性した蛋白質分子の可逆的会合状態(RO) |
|
|
|
|
|
|
 |
|
変性した蛋白質分子は一般に会合しやすく、不可逆的に大きな凝集体を形成して不溶化する場合が多い(「蛋白質」という名前は凝集体が溶液中で白く見えることから)と考えられています。ゆで卵が温度を下げても生卵に戻らない主な原因はこの凝集形成の不可逆性のためです。しかし、最近の研究で、変性した数分子の蛋白質分子が可逆的に会合して平衡論的に安定な一つの熱力学的状態を形成する例が、様々な蛋白質で報告されてきています。そして、この会合体が、不可逆的凝集体の一種であるアミロイドを形成するための核の前駆体になっている可能性を示す実験結果も報告されています。我々は、このような変性した蛋白質が形成する可逆的な会合体をRO(reversible oligomer)と呼んで研究を続けています。
【Reference】最新の原著論文、最新の解説 |
|
|
|
|
|
|
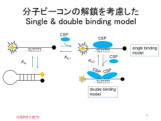
| (T.2) 一本鎖核酸への低温ショック蛋白質(CSP)の結合機構 |
|
|
|
|
|
|
 |
|
低温ショック蛋白質(CSP)は、一本鎖核酸に強く結合し、細胞中での核酸の立体構造を制御する重要な機能を持つ。結合能の解析には、滴定熱量測定(ITC)等が使われるが、感度の問題から通常μM程度の濃度で行われる。これらのデータは単純な1対1モデル(single binding model)を用いて解析されているが、結合定数の温度依存性から求めたvan't HoffエンタルピーとITCで直接測定された熱測定エンタルピーと一致しないという問題があった。我々は、安定性を制御して設計した分子ビーコン(MB)を用いることで、蛍光測定により、nMレベルの高感度での結合性およびμMレベルの結合性の評価に成功した。その結果、特異的にCSPが結合する塩基配列に1分子が結合する場合の結合定数は、ITCで評価されていた値よりも1桁大きいこと、μMの濃度では、一本鎖核酸にCSP2分子が協同的に結合することで、結合定数が過小評価されていることが示唆された。
【第60回記念熱測定討論会、京都府立大、2024年9月27日】要旨 |
|
|
|
|
|
|